-
製品トピックス
CTCLS、電子実験ノートによるCMC分析業務改善ソリューションセミナーを開催
製薬・医療機器を始めライフサイエンス業界にソリューションを提供しているCTCライフサイエンス株式会社(以下、CTCLS)は、2014年12月9日(火)、東京都品川区のゲートシティ大崎にて、「電子実験ノートによるCMC分析業務改善ソリューションセミナー」を開催しました。

2014年7月、日本のPIC/S加盟による規制当局の査察の変化に伴い、製薬企業の製造・CMP部門では、コンプライアンス強化を目指し、試験に関する記録の紙から電子化について注目が高まっています。
このような背景を受けて、CTCLSは、電子実験ノートの有力ベンダーの一つであるダッソー・システムズ・バイオビア株式会社(以下、BIOVIA社)と共同により、CMC領域の分析業務における、電子実験ノートの有用性や導入時に考慮すべきポイントなど情報提供するため、セミナーを開催しました。
PIC/S加盟によるCMC分野における影響とELNソリューションの役割

シニアコンサルタント、PMP(Project Management Professional)
末永 達也 様
インテグリティ・ソリューションズ株式会社のシニアコンサルタントとしてご活躍されている末永 達也 様は、過去に多数の製薬会社のGxP規制対応システム導入、コンピュータ化システムバリデーション(以下、CSV)、ER/ES対応に携わられたご経験に基づきご講演頂きました。2014年7月、日本のPIC/S加盟など最新の規制動向を踏まえ、今後のGMP査察では製造部門だけでなく、上流のCMC部門にも与える影響について詳しく解説頂きました。
以下は、ご講演の概要です。
電子実験ノートで作成した指図書や記録について、これらの文書や記録がPIC/Sの査察対象として取り上げられた場合に備え、査察に耐える品質を担保するにはどのような準備が必要となるでしょうか。特に電子実験ノートを使用することで、紙の場合と比較して、かえって手間が増えるというようにお考えではないでしょうか。
なお、ここで、担保すべき「品質」には、指図書や記録の内容そのものと、それらを作成するための手順の両方が含まれると考えてください。
つまり、最終的な文書や記録の内容は、規定された教育訓練を受講した有資格者により、最新のテンプレートを使用する等の規定を遵守して作成され、さらに記載内容について第三者によるQCが行われ、最後に責任者によって承認されるという手順を経ることによって、初めて「品質」を担保したものとして認められます。正当な品質保証のためにこのような手順が求められるのは電子的に文書や記録を作成する場合でも、手書きで作成する場合でも同じです。電子実験ノートを使用したからといって、そのことで手順が煩雑化するというものではありません。
むしろ、電子実験ノートを使用した場合の方が、逸脱の発生を予防できるという意味で、業務の全体効率という観点からは効率の向上につながるとも考えられます。(もちろん、査察において逸脱が多いというのは明らかにマイナス点です)
例えば、あるユーザーが電子実験ノートで文書や記録を作成しようとするとシステムが自動的に教育訓練記録に問い合わせ、そのユーザーの教育訓練記録が存在するかどうかを確認する、ですとか、第三者QCが完了していないと承認者が承認できない等の制御をシステムに組み込むことにより、重大な逸脱の発生を事前に予防することが可能になります。また、記載ミスや記載漏れの検出をシステムにまかせることで、記載ミスや記載漏れが減少するだけでなく、同時に、これまで記載ミスや記載漏れの検出にかけていたQCの手間を大幅に削減することもできます。
このように、むしろ、作成の手順を含めて「品質」の担保、逸脱の予防が求められる場合にこそ、電子実験ノートでの文書や記録の作成が適しているとも言えます。
今後、PIC/Sの査察対象として文書や記録が取り上げられるとすれば、より厳しさを増す査察対応のためにも、電子実験ノートによる文書や記録作成に取り組まれることを強くお勧めしたいと思います。
試験法の検討/実施の各段階における電子実験ノートの活用

課長 山本 博資
CMC領域における電子実験ノートの活用方法について紹介しました。CMC領域を取り巻く規制環境は変化しつつあり、日本のPIC/S加盟により、製造申請承認前の査察では、上流工程であるメソッド・バリデーションの手法やメソッド確定の経緯までもが査察対象となるなど、規制の強化が予想されています。またCMC領域の業務では、多くの種類の分析機器が利用されています。分析機器の進化に伴い、出力されるデータが膨大になるに連れ、紙でのデータ管理が困難になってきています。そのため、紙のデータを運用している同部門の業務では、QC業務における作業負荷やデータ散逸による情報共有性の欠如が共通課題となっています。データの電子化は、これらの課題に向けた解決策という認識が広まっている一方で、電子化による業務効率化の実現性に疑問視する声もまだまだ多いと言えます。また、データの信頼性や、規制当局への申請用データとして利用可能かどうか、更に費用対効果(以下、ROI)についての懸念もありますが、電子実験ノートはこれらを十分クリアできるシステムと考えております。
海外では、CMC領域での電子実験ノートが導入された実績は多くあります。「製造用ドキュメントを準備する時間が50%以上削減された。」、「ユーザー1人当たりの生産性が年間7万5千ドル向上した。」などといったROIが発表されています。国内製薬企業でも、電子化へ目を向ける企業が増えており、今後2~3年以内に導入が進み、ROIとはじめとした実績が増えていくと見込んでいます。CTCLSがご提供するBIOVIA Electronic Lab Notebook(以下、BIOVIA ELN)は、CMC領域における分析業務で利用可能な電子実験ノートです。基礎研究から申請に必要なデータの記録まで幅広くカバーします。特に、製造部門では、試行錯誤の研究段階や信頼性の確保が求められるバリデーション段階、信頼性の高い記録が求められる試験実施段階において、BIOVIA ELNは適性な記録と作業効率の向上を実現します。
この製品は、電子実験ノートの基本機能を網羅しており、履歴管理や電子署名機能も有しています。ワンプラットフォームで、部門横断的に複数の創薬フェーズでの利用が可能です。また、テンプレート化による実験情報の記録は業務の効率化や最適化の点で効果的です。基礎研究のような、試行錯誤を含む定型化されていない業務には、ScapBookと呼ばれる非定型なテンプレートが用いられます。このように自由度の高いテンプレートがある一方、申請用データなど信頼性の高い記録に特化した、業務ルールを堅固に適用したテンプレートいずれにも対応します。

CMC領域の業務では、各種分析機器との接続機能は重要です。BIOVIA ELNは、Waters社Empowerとの連携は標準アダプタで提供されており、島津製作所とのLabSolutionsとの連携機能も現在開発が進められているなど、機能拡張を続けています。また、電子天秤や、バーコードプリンタ、Print to Notebook機能(分析機器室にあるソフト上のチャート送り機能など、直接接続に対応していない機種でも、実験室での情報入力を支援する機能)も装備しています。
また、専用のモジュールを利用することで、実験室からでもスマートフォンなどのモバイル端末により、居室で作成した実験計画などを参照できるほか、実験室で撮影した検体の写真やデータなどをリアルタイムで記録・保管することができ、業務効率を大きく改善します。
電子実験ノートが複数の部門に跨って利用されるようになると、例えば分析部門と製剤部門のノートが互いに見えるようになりリアルタイムに依頼した分析試験のステータスの確認や、依頼したサンプルの製剤組成の閲覧など、部門間連携に必要な、情報共有が容易に行えます。また、承認者の視点では、実施された実験数、実験の承認のステータス確認などができるようになり、管理業務の負荷軽減を大きく支援します。
分析機器と電子実験ノート連携による業務の効率化

CTCLS 営業・技術本部 技術第2部
下田 由紀子
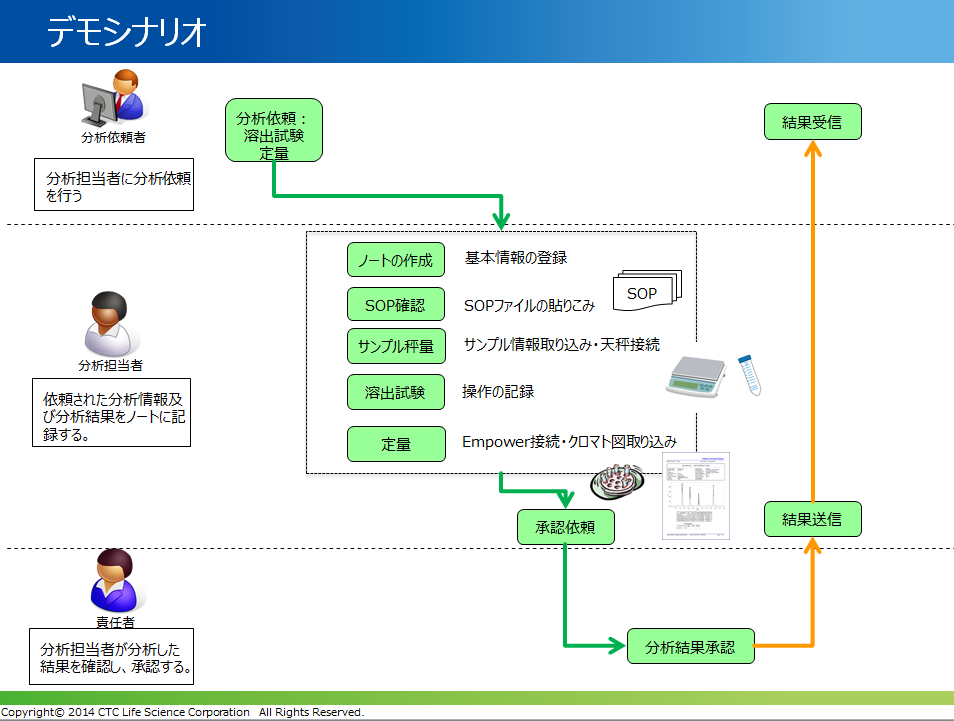
BIOVIA ELNの基本機能の紹介に続き、HPLCによる分析業務を想定したシナリオ(下図)に従い、デモンストレーションを行いました。
BIOVIA ELNとWaters社Empowerとの連携では、まずBIOVIA ELNで作成したシーケンスデータをEmpowerに転送する機能を紹介しました。その後、Empowerが取り込んだ測定機器からの生データおよび解析結果を、BIOVIA ELNにダイレクトに登録する画面も見せることで、両ソフトウェアが双方向にデータ授受できる点を説明しました。更に、電子天秤などの機器やプリンターとシリアル接続させて使用するなど、業務に即したデモ内容に参加者は興味深く聴講する姿が印象的でした。このように、現在紙ベースで運用することでQCチェックに人員を割いている分析業務は、電子実験ノートと分析機器を連携させることで、大幅な業務効率化に繋がると説明しました

電子実験ノート情報の二次利用について

道賀 康祐
電子実験ノートに蓄積される電子データの活用方法について紹介しました。実験記録を電子化することで、過去の実験記録の検索・参照や部門間の情報共有を始め、技術移管の加速化、QbD申請に向けたデザインスペース検討、定型レポートの自動作成など様々な目的に応じた二次利用が可能となります。BIOVIA社が提供するPipeline Pilot(以下、PP)やDiscoverantなどのCMCソリューション製品群により、上述のようなデータ利活用を実現します。
PPは、国内製薬トップ25の殆どの企業が導入しているワークフローツールです。様々な処理(コンポーネント)の組合せにより目的に応じた処理ができ、画像、テキスト、化学構造、バイオロジーデータ、スペクトルデータなど、ライフサイエンス領域に特化したデータの解析が行えます。また、PPを電子実験ノートに組み込むことで、複数の試験結果からのレポート作成や、Waters社Empowerから主成分の面積比を比較などにも応用できます。製剤化検討では、Design OF Experiment(実験計画法)、ワークリクエスト、ジョブの割り振りなどの業務フローを最適化します。
PPに加えてDiscoverantも利用することで、プロセス開発から商用生産部門における、技術移管の高速化を支援します。
規制環境における電子実験ノートの運用について

申請用データの記録・管理など、規制環境において電子実験ノートを信頼性の高い運用を実現するために認識すべき課題や、これらの課題に向けたBIOVIA社の取り組みについて発表しました。
CMC領域の研究者にとって、電子実験ノート導入に興味はあるが、申請データ管理に利用可能かどうかといった不安を抱えているケースが多く見受けられます。特に、適合性書面調査に対応可能なのかどうかが最大の関心事となっています。
このような懸念に対し、BIOVIA ELNは、セキュリティ設定、QC履歴、タイムスタンプなど規制要件を満たす機能を有しており、申請用データの管理に対応可能なシステムと説明しました。
またBIOVIA社が主催するBIOVIA ELN Forumでは、行政機関も交え、ユーザー間で電子実験ノート導入による非臨床領域の申請資料に係る実験記録の電子化に関する情報交換を目的とし、今後も定期的に開催します。
BIOVIA strategy of paperless lab solution: Process oriented datamanagement system makes your life easier

Product Marketing Manager,
Dr. Daniela Jansen
BIOVIA社が提供する電子実験ノートやLab Execution Systemなどプロセスベースのデータ記録、管理システムの利点について講演しました。研究所には膨大な紙のデータが存在しますが、紙をベースとしたデータ運用・管理には業務負荷が掛かるだけでなく、手書きによるエラー発生やデータ紛失による再試験の実施など、業務効率性やコストの面で様々な課題があります。しかし、最大のボトルネックは組織を跨った情報共有が困難な点です。組織内外のメンバーとの円滑な情報連携は、イノベーティブな活動を行う上で不可欠です。これらの課題に対し、システム導入によるペーパーレスラボ化(電子化)は情報共有性の飛躍的な向上やコンプライアンス強化にも繋がり、大きな投資対効果も見込めます。特に、CMC領域では、厳正なコンプライアンスや業務の自動化が求められているため、電子化による効果が得られやすいと考えています。
システム導入に向け、ユーザー側で、システムに求める要件を明確化し、要件に合ったベンダー選択が重要となります。BIOVIA社は、全世界で数多くの導入プロジェクトに携わった豊富な経験により、CMC領域において初めて電子化に取り組むユーザーのスムーズなシステム導入を支援します。
CTCLS最新ソリューションのご紹介~品質ソリューションの提案~

課長 山本 博資
CTCLSの山本より、CMC領域に関連する品質管理ソリューションを紹介しました
以下が、当発表の概略です。
CTCLSは、BIOVIA ELNのほか、品質管理システムソリューション「QUMAS」と、それらアプリケーションを乗せて使用が可能な、インフラ基盤「PharmaCUVIC」といった、アプリケーションとインフラの両方の側面から、お客様の業務を支援します。

日本が2014年に加盟したPIC/Sには、世界中では既に40~50か国が加盟しており、グローバルスタンダードのGMP査察ルールと見なされています。米国がPIC/Sに加盟した2011年を境に、FDAのWarning Letterの数が前年比約3倍と増加し、更に2013年には約1.5倍と上昇傾向を見せており、PIC/S加盟による関連が示唆されています。更に、2012年の査察における指摘事項の内訳によれば、47%が品質システムの不備に関連しています。
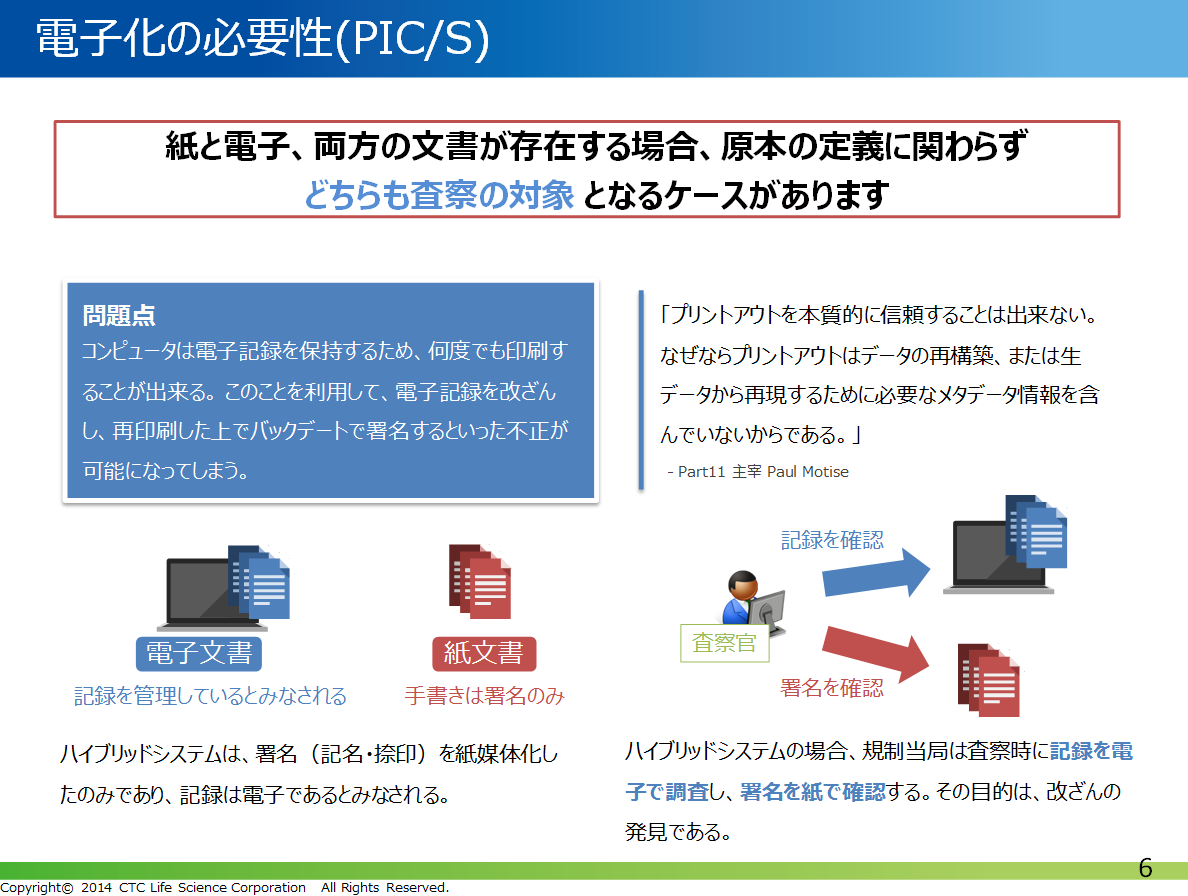
PIC/S査察の場合、紙と電子両方の文書が存在する場合、どちらも査察の対象となるケースがあります。そのため、紙との共存よりも完全に電子化した方が品質管理上安全であると考えられることも少なくありません。各都道府県の査察においても、PIC/Sガイドラインに則っており、データの電子化体制の構築に取り組む動きが近年活発に見られるようになりました。
このように、強化されるGMP査察に向けた対応策が、QUMASソリューションです。QUMASは、文書管理、品質プロセス管理、外部ベンダーとの共有、教育訓練管理、苦情管理などワンプラットフォームで様々な品質管理機能を利用することができます。同ソリューションでは、20年以上に渡りグローバルの規制動向をウォッチし、顧客からの要望を製品に反映したベストプラクティスパッケージです。短期間、低コストで提供でき、パッケージ製品のため、概ねGAMP5のカテゴリ3によるCSV実施で導入が可能です。これは、ユーザーにとっても導入時の負荷を大きく軽減します。

ライフサイエンス業界向けクラウドサービスPharmaCUVICは、CSVが実施済みである、PIC/S査察対応にも可能なインフラ基盤です。ユーザー自身で、GxP規制に対応したインフラ環境を構築する場合、システム運用における運用障害監視や変更発生時の手順作成や、CSVドキュメント一式の準備が必要となりますが、これは大変負荷の掛かる作業です。PharmaCUVICにより、ユーザーはバリデーション作業を簡略化し、QUMASやBIOVIA ELNなどのアプリケーションを乗せて利用することが可能になります。
CTCライフサイエンス株式会社について
CTCLSは1989年の創業以来、製薬企業を中心としたライフサイエンス業界のお客様を対象にICTソリューションの提供を通して、その課題解決に貢献してきました。CTCLSの強みは、伊藤忠テクノソリューションズ(CTC)グループの最先端かつ広範なICT技術力、先進のサイエンスを取り入れた製品を有するベンダーとの強固なパートナーシップ、そして薬学や生命科学に関する深い理解と豊富な業務知識に基づくコンサルティング力です。これらを活かして、ICTとライフサイエンスの両方の視点から、海外の最先端のサイエンス製品とICT製品・サービスを融合し、単なるシステム構築にとどまることなく、お客様ごとの業務や課題を踏まえた最適なソリューションを提供します。
CTCLSの詳細については http://ls.ctc-g.co.jp/index.html をご覧ください。
以上
製品ご紹介ページ(発表順)
- エンタープライズ電子実験ノートシステムBIOVIA社Electronic Lab Notebook
- サイエンティフィック・ワークフロー・オーサリング・アプリケーション
- QUMASコンプライアンスソリューション:QMSにおける法規制・査察・監査に対応するGxPコンプライアンスシステム
- PharmaCUVIC:ライフサイエンス業界向けクラウドサービスPharmaCUVIC
※記載されている商品名などの固有名詞は、各社の商標または登録商標です。
※掲載されている情報は、発表日現在の情報です。最新の情報と異なる場合がありますのでご了承ください
本件に関するお問い合わせ先
以上
伊藤忠テクノソリューションズ株式会社
ライフサイエンス事業部
TEL:03-6403-2213/E-mail:
ls-marcom@ctc-g.co.jp