-
製品トピックス
CTCLS、医薬品・医療機器業界向けPIC/S査察対応 QMSコンプライアンスソリューションセミナーを開催
GxP文書、品質イベント(逸脱、変更、CAPA、苦情)、教育訓練の管理、PIC/S査察対応の課題を解決する最新ソリューションの提案
製薬・医療機器を始めライフサイエンス業界にソリューション提供を行うCTCライフサイエンス株式会社(以下、CTCLS)はこのほど、CTCLS主催による「医薬品・医療機器業界向けPIC/S査察対応 QMSコンプライアンスソリューションセミナー」(以下、本セミナー)を開催しました。本セミナーは2014年10月、東京と大阪の2会場で各1日行われました。

2014年7月、日本のPIC/Sへの加盟が承認され、国内のPIC/S準拠のGMP査察ではより厳正な法令遵守が求められるようになります。こうした背景を受けて、規制対応文書や品質イベント情報の管理体制の見直しが行われ、課題解決に向けたシステム導入による業務効率の改善や品質の向上への注目が高まっています。
製薬を中心としたライフサイエンス企業より、多数のお客様にご来場いただき、コンプライアンス強化への意識の高さがうかがわれました。
開会のご挨拶

代表取締役社長 横山 良治
冒頭、挨拶に立ったCTCLS代表取締役社長 横山良治は、「いち早くグローバル化が進む製薬業界では、国内の規制に対応するだけでなく、海外にも目を向けなければなりません。特に人の健康や命を支える製薬企業においては、世界基準の厳正なコンプライアンスが求められています。今年加盟したPIC/Sにより、各企業においてもコンプライアンスに向けた可及的速やかな対策が迫られていることは周知のことと思います。
そうしたなか、QUMAS社は、ライフサイエンス業界で20年以上に渡りコンプライアンスソリューション提供における豊富な実績があり、皆様の業務プロセスの見直しや改善を支援するソリューションになり得ると確信しています。本日は、グローバルにおける規制が変化する背景を踏まえながら、QUMAS社が提供する製品やソリューションを中心に、国内や海外の事例までご紹介させていただきます」と語りました。
キーノート:グローバルレギュラトリーとテクノロジートレンドの考察

Compliance Consultant
Warren Perry氏
QUMAS社Perry氏は、「グローバルレギュラトリーとテクノロジートレンドの考察」と題して、QUMAS社の概要や、米国および各国規制当局における最新動向が及ぼす国内製薬会社への影響について発表しました。
以下が発表の概略です。
アイルランドを本拠地に置くQUMAS社は、グローバルにおける品質システムの提供では20年以上の豊富な経験を有しています。QUMAS社は現在ダッソー・システムズ・バイオビア株式会社(以下、BIOVIA社)の一員として、コンプライアンスシステムの提供を一層強化した活動を行っています。
2012年にマンデートドラフトガイダンスが発令された「FDA安全およびイノベーション法(FDASIA)」が2016年1月に正式に施行されると、製薬企業は「1.電子申請の義務化」「2.ユーザーFee法に則った査察に必要なコスト負担」など、様々な影響が想定されます。一方で、紙での新薬申請で時間を要していたため、承認申請業務のスピード向上による効率化が見込めます。
また、GMP査察分野における加盟当局の協力関係を推進・強化するグローバルの協定・スキームであるPIC/Sへの加盟後には、GMP査察に対応するコンプライアンスの徹底が必要となります。米国市場で製品を販売する場合には、FDAが要求するコンプライアンス基準を満たすことが必須要件となり、変化の激しい規制に対して、QUMAS社とCTCLSは強固なパートナーシップのもと、お客様へのシステム提供を通じて業務支援に貢献したいと考えております。
CTCLSが提案するPIC/S査察対応ソリューション
CTCLSマーケティング部の製品担当者より、GMPコンプライアンス管理が重要となる背景について説明しました。
以下が発表の概略です。
GMPコンプライアンス管理業務の課題
GMPコンプライアンス管理業務の課題として、医薬品企業の国際化に伴うGMP査察の変化が挙げられます。PMDAによる主な指摘例には、変更管理、逸脱管理、文書管理の管理不備などの不適切な記録に起因するものが多いです。こうした傾向は海外でも同様であり、FDAによる指摘内容の47%が品質システム、特に文書・記録の不備に起因するといった報告もあります。
このように、記録不備が発生する理由の1つに、手順書などの記録は人に依存しているため、ヒューマンエラーが発生してしまう潜在リスクが考えられます。日々の文書更新による改訂履歴や版管理などが徹底されていないと不備に繋がります。
また、FDAからCAPAの指摘を受けた際、SOP文書などを品質管理システムで管理していない場合、更にその対応は困難になります。しかし現実には、このように文書と品質プロセスを連携させた管理は難しいと考えられていました。
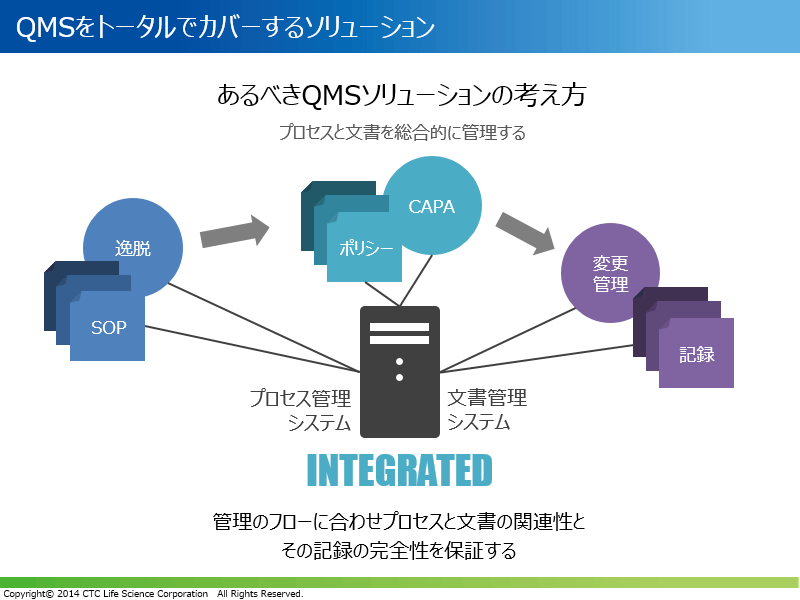
QUMASコンプライアンスソリューション
従来型の品質管理システムでは、文書管理と品質イベント管理が独立したシステムでした。そのため、SOPや各種記録などの文書と、それらに関連する逸脱、CAPA、変更管理など品質イベントが紐付けられて管理されていませんでした。しかし、今後の品質管理システムの理想像としては、業務フローに合わせて、品質プロセスと関連する文書、またその記録の完全性の保証が重要と考えられています。
QUMAS社のコンプライアンスソリューションは、過去20年に渡る数々の品質管理システム導入の経験に基づいたベストプラクティスパッケージです。品質イベント管理と連携した文書管理、教育訓練管理をワンプラットフォームで実現します。この統合ソリューションは、GMP査察にも耐えうる標準的な機能を予め装備しており、短期間で本番運用の開始できる点が特長です。
国内導入顧客事例のご紹介

技術第2部 飯島 顕二郎
2011年の某国内大手製薬企業のQUMAS文書管理システム導入案件において、プロジェクトマネージャーを務めた飯島より、当時を振り返りながらQUMAS製品導入の経緯や目的について発表しました。
以下が発表の概略です。
このプロジェクトで特筆すべきは、導入決定からわずか7ヶ月後という短期間で本稼働開始した点にあります。数百名規模の運用に耐えられるシステム構築といったハードルの高さにもかかわらず、スケジュール通りプロジェクトを遂行し、予定期日に本番運用をスタートさせました。
この短期間で導入可能な点が、QUMAS製品が選ばれた最大の理由ですが、他にもお客様がグローバル展開を見据えていたのに対し、QUMAS社は海外での導入実績が豊富で、海外規制当局による査察対応にも安心して利用できる点などが高く評価されました。また、現行の紙文書の運用に合わせたシステム実装において、プログラム開発は一切不要とし、アプリケーションの設定レベルで優れた柔軟性を持つことも選択された理由の1つでした。
文書管理の機能においては、システム設定がテンプレートから適用可能なため、初期設定が容易に完了しました。また、ユーザー要件仕様書(URS)や機能仕様書などQAドキュメント類がサンプルとしてパッケージ提供されることから、ドキュメントタイプを一から定義することなく進められました。また、ベストプラクティスを基盤としてスタートできたことから、効率の良い検討が行えました。このように、従来と比較して要件定義にかかる時間を大幅に短縮できました。
特に有用と評価されたのは、「共同レビュー」という、ユーザーが登録した文書を上長がレビュー承認する際に、複数人同時に編集できる機能です。これは、頻繁に行われるSOP改定において承認業務の負荷の大幅な軽減に効果的です。また、「文書の関連付け機能」があり、文書間のさまざまな条件での紐付けが可能であり、文書本体を変更せず添付文書のみ改訂する場合や、関連付けの条件を逸脱する場合には警告メッセージによる間違った操作を予防する仕組みによる確実な管理ができることがシステム導入における大きなメリットと見込まれていました。
導入から3年経過した現在も、QUMAS製品のアプリケーションに関する障害が全く起きておらず、業務の効率と品質の向上に繋がったという声も聞くなど、お客様は大変満足して利用しています。今後、お客様はQUMAS製品をベースとした品質システムのカバー範囲を拡張することで、海外拠点への展開を目指す上でQUMAS製品は不可欠なシステムとなりました。
QUMAS DocComplianceが実現するQMSの基盤となるベストプラクティス文書管理の紹介

技術第2部 石井 輝亜
QUMAS製品技術者の石井より、QUMAS DocCompliance™を基盤としたベストプラクティスのQMSソリューションについて発表しました。また発表の最後には、同製品の最新版のデモンストレーションも行いました。
以下が発表の概略です。
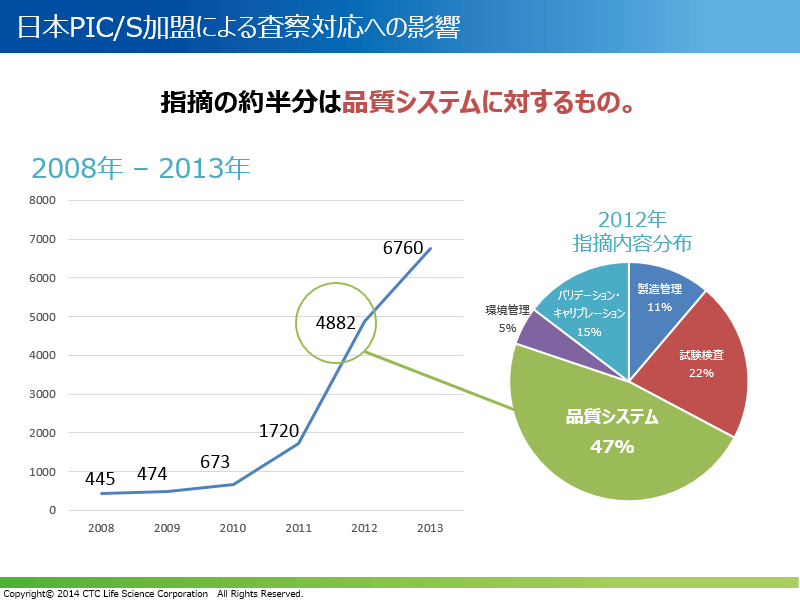
日本のPIC/S加盟による査察対応への影響
2008~2013年にかけて、FDAによる査察での指摘が増加傾向にあり、特に2011年を境に爆発的に増えています。この要因には、査察回数の増加や近年リスクベースドアプローチによる査察の強化が根底にあると考えられます。また同年には、米国のPIC/S加盟したことも重要に関連していると考えられており、FDAからの指摘の約半分は品質システムの不備という結果が報告されています。
今年PIC/Sに加盟した日本においても、査察での指摘事項が増えているといった声を多く聞きます。
査察に求められる文書管理システムとは?
査察官は、GMP製造現場において残存するリスクが存在しないかどうか、また、問題が起こった場合の対応状況について評価します。その際に、査察官に対して、品質システムにおける解決策や再発防止策の確実性や正当性を示す論理的な証明が求められます。
品質保証業務では、査察対応の文書管理は重要な位置付けとなっています。品質システムにおけるCAPA、逸脱、教育訓練など各種イベントの記録は文書です。査察官へ提示するのが資料だからこそ、文書管理は重要になります。QUMAS社は、各種イベントと連携して管理可能な文書管理を中心に、一連の品質システムワークフローをカバーするような製品ラインアップを取りそろえています。

QUMAS DocCompliance™製品紹介
QUMAS DocCompliance™は、CFR Part 11やER/ESに対応しており、各国の規制法規を満たす文書管理機能を装備したシステムです。文書の閲覧、文書の保管など典型的な文書管理システムの機能を持ちながら、文書ライフサイクル管理や監査証跡機能を有し、GxP業務での利用が可能です。
またMyQUMASを通じてQUMAS DocCompliance™はじめ、Webブラウザー上で各種アプリケーションの連携さながらの利用が可能です。文書作成やCAPA発動など一連のワークフローを統合管理、単一プラットフォームで全ての業務が行えます。また、文書のライフサイクルマネージメントにおいては、各文書のステータス(レビュー中、承認済みなど)やバージョン管理なども一覧できます。また、エンドユーザーには最新の文書しか表示されないため、誤って古いSOPを参照するといったヒューマンエラーの防止にもつながります。
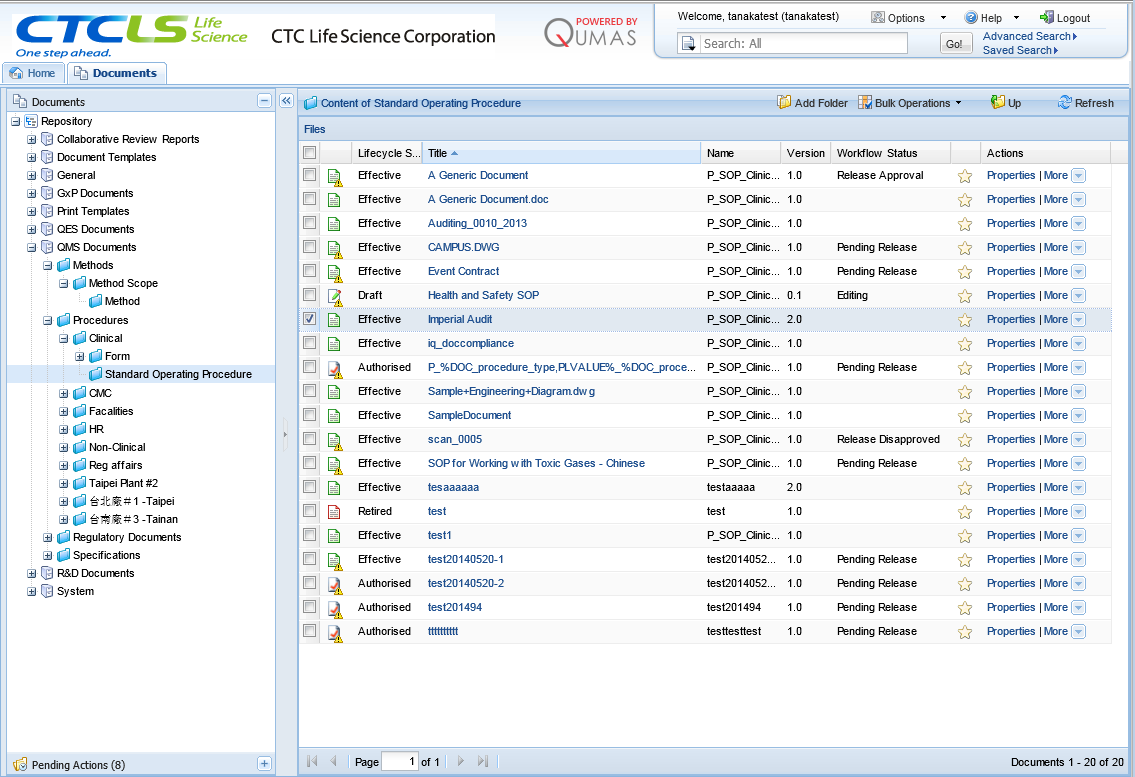
査察における具体的な利点は、コンフィグレーションによる業務ルールを適用し、文書を補完する統一フォルダー構成が可能な点や誤記を防げることです。このようなフォルダー構成の不備も指摘項目になり得るため重要です。また査察時は、文書検索機能を用いることで、必要な情報を瞬時に取り出し、査察官に見せることが可能です。たとえば、何らかの逸脱が起こっていた製品について関連文書までトレースできるような品質イベントと文書が互いに連動した管理システムは、スムーズな査察を支援します。また、電子署名も保存した理由と共に記録されることから、査察官に好まれる機能です。
承認者画面に、1年間に作成された文書数とそのステータスを一覧表示させたり、グラフなど可視化させて組織内の文書全体を分析したりすることが可能です。レビューが止まっていた場合、どの承認者で止まっているかなどの原因究明もシステムにより容易に行えます。
このように、査察を潤滑に進めるだけでなく、ヒューマンエラー防止により査察での指摘事項の減少に貢献します。
社外パートナーとのコラボレーションを促進する
QUMAS iXサービスの紹介

Compliance Consultant
Warren Perry氏
QUMAS社Perry氏によりQUMAS製品ラインナップの概要を述べたうえで、2013年にリリースされたQUMAS iXにフォーカスした紹介を行いました。
以下が発表の概略です。
20年前にQUMAS社は、文書管理システムQUMAS DocCompliance™を主軸にスタートしました。以降、ライフサイエンス企業の開発領域における品質全般に関わるCAPA・逸脱などプロセス管理のニーズが高まったことから、QUMAS ProcessCompliance™が開発されました。続いて、MyQUMAS、QUMAS ComplianceSP™、QUMAS iXの順に開発・リリースしましたが、これらは全て顧客からの要望を受けて製品化したものです。また、製品が増えるに伴い、これらのワンプラットフォームでの統合的な利用が重要になりました。
また、昨今の製薬企業では、製造や臨床試験などの業務をCMOやCROなどに外部委託するニーズが高まっています。外部委託において、製薬企業と委託先のデータや文書の授受は、殆どの場合メールやDVDでのやり取りで行われていました。しかしこの方法では、規制に対応したコンプライアンスが徹底されず、たとえばSOPなどの文書について、誰がどのバージョンを受け取ったか分からない、監査証跡が取れないことなどが大きな課題となっており、査察にも対応が困難な状況でした。
そこで、製造や治験などの外部委託に向けたクラウドベースの情報共有プラットフォームとして開発されたのがQUMAS iXです。QUMAS iXを利用することで、SOP・試験プロトコル・アッセイ結果などの規制対応文書をはじめ、プロジェクト計画書・契約書・品質管理の取り決め書など規制対象外の文書や、物販情報、製品の開発進捗など関連情報も含めてセキュアに情報交換が可能です。SharePoint上で、製薬企業と業務委託先の双方がリアルタイムに情報共有できるようになります。
QUMAS LMSによる教育訓練管理システムのご紹介

営業第2部 平野 勝久

技術第2部 込山 雅人
2014年10月、本格的に提供開始したGxP業務に対応した教育訓練管理システムQUMAS Learning Management, powered by NetDimensions(以下、QUMAS LMS)が、PIC/S準拠の GMP査察対応にどのように課題解決できるかについて紹介しました。
以下が発表の概略です。
教育訓練管理におけるPIC/S GMP査察対応
教育訓練管理は、PIC/S準拠GMP査察の対象になります。平野が毎年参加する品質保証業務担当者が参加する研究会では、査察対象となる情報管理を目的としたコンピューターシステムの導入の必要性については、しばしば議論になっています。大半の製薬企業は、一連の品質管理ワークフローのうち文書管理やプロセス管理について部分的な電子化対応はしているものの、教育訓練管理の電子化までは到達していないことが多く、紙やExcelでの管理が多く見受けられます。そのため、従来の管理方法では、教育訓練の記録漏れといったヒューマンエラーの発生など、査察時の指摘事項になるような潜在的なリスクが存在します。
そこで、PIC/S加盟に向けた対応として教育訓練を実施・管理する仕組みの見直しが必要と考えられます。
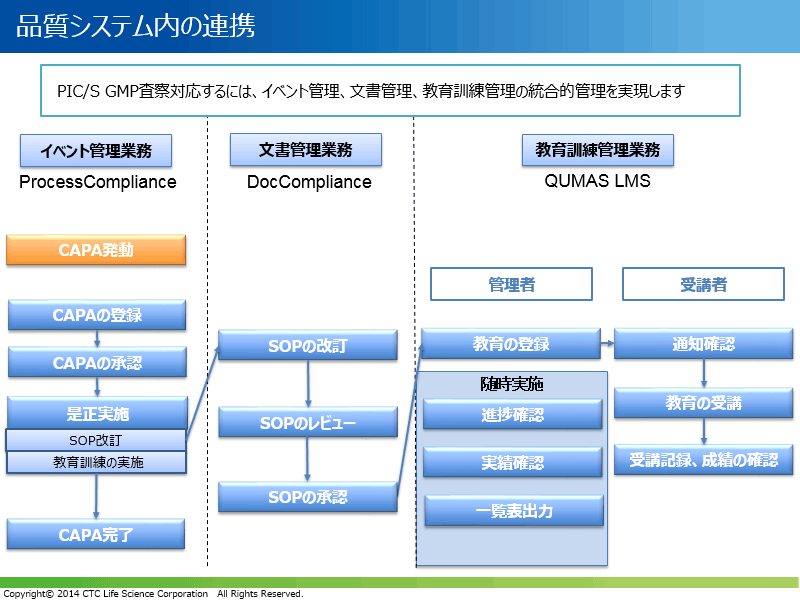
他QUMASシステムとの連携
PIC/S準拠GMP査察では、たとえば、逸脱によりCAPAが発動し、SOPを改訂した場合は関係者に最新版のSOPに添った教育訓練を行う必要があります。このように、品質イベントやそれに関連文書と連動した教育訓練管理が重要です。日本の製薬企業においては、品質に問題があることは少なく、逸脱の発生自体が多いとは言えません。それよりも、記録の付け漏れなど人為的な問題に起因する指摘事項が多く、これらはシステム化による対策が有効と考えられます。QUMAS LMSは、イベント管理や文書管理と連動するといった品質システム内の連携が取れた統合システムです(下図)。
QUMAS LMS製品紹介
QUMAS LMSは、Webブラウザー上のMyQUMASから起動させることができ、操作性の良いシステムです。QUMAS LMSは、FDA査察の教育訓練に関するWarning Letterに含まれる指摘事項(下図)の発生を、効果的且つ未然に防ぎます。
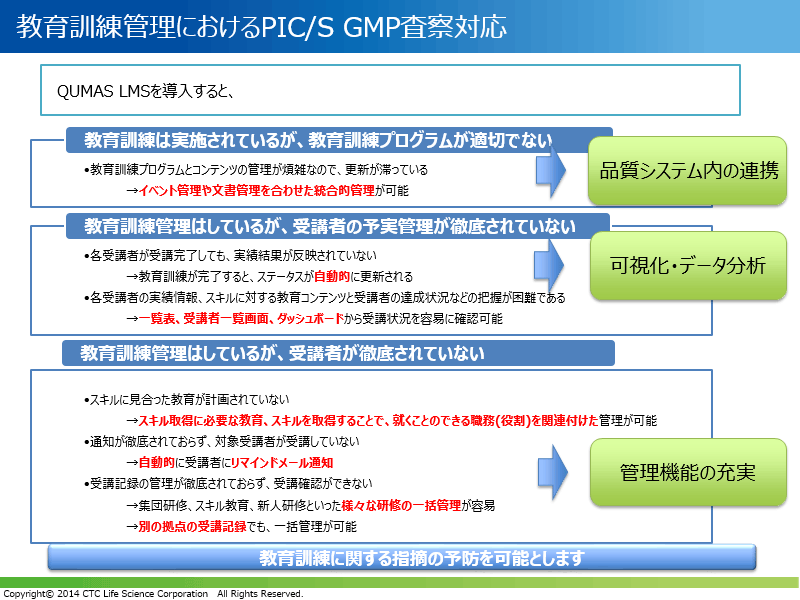
GxP業務に必要なスキル管理機能など、教育訓練管理上のヒューマンエラーや作業負荷を減らすための種々の機能を実装しています。個人ごとに受講すべき教育訓練と文書管理システムに格納されている品質管理業務手順書など、教育に必要な文書と教育訓練を紐付けての管理が可能です。また、従来のExcelや紙ベースによる管理では困難だった組織内受講者の教育訓練進捗一覧表示、ダッシュボード表示によるデータ可視化やデータ分析に優れており、教育訓練管理業務を強力に支援します。
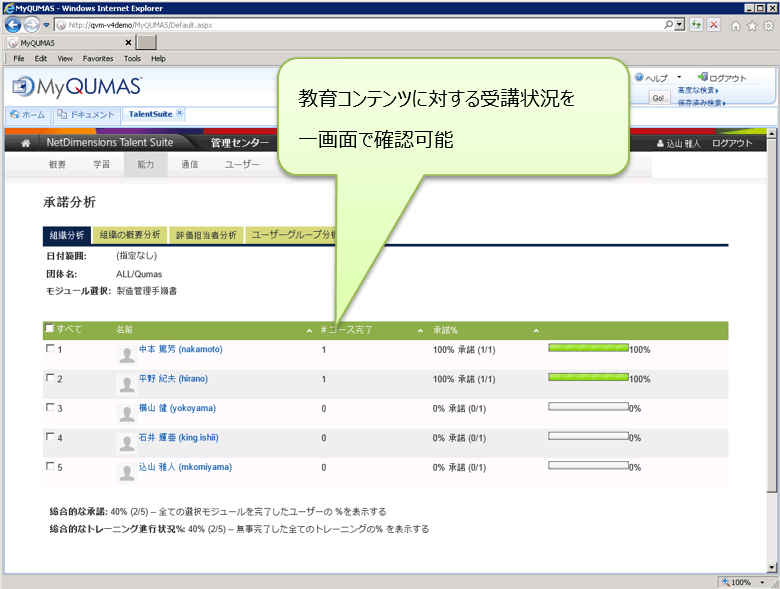
海外導入顧客事例のご紹介

Global Regulatory Affairs Associate Director
Matthew Wickert氏
海外ユーザー事例として、バイオテクノロジー企業Vertex Pharmaceuticals Incorporated(以下、Vertex社)のWickert氏が、QUMAS製品の導入事例について発表しました。まず、Wickert氏はQUMAS製品の導入の経緯について説明しました。米国ボストンを本拠地におくVertex社は、他にカナダ、ヨーロッパ、オーストラリアなどグローバルに多数の拠点を持ち、技術文書などの共有が課題になっていたと述べました。
最初はGMP領域でQUMAS製品を導入していましたが、FDAへの新薬承認申請の電子化対応に向け、2008年にQUMAS DocCompliance™、MyQUMAS、QUMAS Enterprise Scanning、DocTransferを導入しました。
続いて2013年には、CROとのコラボレーションにおける情報共有の需要が高まったためQUMAS iXを導入したと説明しました。一連の製品導入で目指していたのは、規制コンプライアンス対応やグローバルへの展開に加え、システム導入による業務プロセスの最適化を図っていたとも述べました。
最後に、Wickert自身がシステム導入に携わった経験を踏まえ、規制対応の文書管理システムを選択する、また導入後に考慮すべきポイントについても説明しました。特に、システム開発ではなく標準機能の設定レベルで業務ルールを適用することが、数年後に業務運用が変わった場合も融通の利くシステムになるといった理由から、予め必要な機能が標準装備しているパッケージ製品の利用を推奨していました。
CSVに標準で対応することで真にトータルなQMSを実現するクラウドサービスのご紹介

マーケティング部 課長 山本 博資
CTCLSの山本が、最新サービスであるライフサイエンス業界向けクラウドサービスPharmaCUVICを紹介しました。
以下が発表の概略です。
製薬業界におけるインフラ基盤利用における課題として、GxP開発業務でコンピューターを利用する場合、コンピューター化システムバリデーション(以下、CSV)が必要とされます。しかし製薬企業にとって、CSVへの対応は、運用監視や障害監視などのシステム運用面やCSVに必要なドキュメント作成の観点からも大変負荷のかかる作業であり、業務の簡素化が求められていました。このような課題への解決に向けて、CTCLSはCSV対応済みライフサイエンス業界向けクラウドサービス「PharmaCUVIC」の提供を開始しました。
現時点では、PaaS型サービスが中心ですが、近い将来、QUMAS製品などのアプリケーションをPharmaCUVIC上にのせたSaaS型サービスまで展開する予定です。
PharmaCUVICは、CSV対応が施されたファシリティ、ハードウェア、ミドルウェアの仮想環境に加え、データセンターに常駐するCSVの教育を受けた専任のオペレータによるシステム運用までパッケージ化されています。インフラ環境のみならず、運用監視もサービスとして提供される点が特長です。
同時にコンピューターシステムの導入と運用に伴う、CSVに必要な計画設計など177種類のドキュメントも完備しています。クラウド環境に付随するドキュメント提供などの一連のサービスは、規制当局による査察に対応可能です。
PharmaCUVICは最短で2週間程度で利用開始可能なため、導入期間の大幅な短縮が図れます。また、バリデーションドキュメント作業が不要なため、設計や文書レビューなどの負荷も軽減されます。
閉会のご挨拶

技術第2部 部長 鬼木 正起
CTCLSのQUMAS製品を担当する技術部門を代表して鬼木より、閉会の挨拶を行いました。鬼木は、「PIC/S対応のGMP査察に注目が集まる中、お客様に最新の情報提供を通じてお役に立ちたいと、本日のセミナーでは我々が提供し得る最大限の内容を盛り込む努力をしました。今後もCTCLSは、QUMAS製品を始めとした、深い業務要件の理解に基づくICTソリューションを提供して参ります」と語りました。
懇親会
セミナー終了後は、懇親のためのパーティを開催しました。CTCLS の鬼木の挨拶の後、QUMAS社を交えつつ、お客様との意見交換が活発に行われました。


CTCライフサイエンス株式会社について
CTCLSは1989年の創業以来、製薬企業を中心としたライフサイエンス業界のお客様を対象にICTソリューションの提供を通して、その課題解決に貢献してきました。CTCLSの強みは、伊藤忠テクノソリューションズ(CTC)グループの最先端かつ広範なICT技術力、先進のサイエンスを取り入れた製品を有するベンダーとの強固なパートナーシップ、そして薬学や生命科学に関する深い理解と豊富な業務知識に基づくコンサルティング力です。これらを活かして、ICTとライフサイエンスの両方の視点から、海外の最先端のサイエンス製品とICT製品・サービスを融合し、単なるシステム構築にとどまることなく、お客様ごとの業務や課題を踏まえた最適なソリューションを提供します。
CTCLSの詳細については http://ls.ctc-g.co.jp/index.htmlをご覧ください。
製品紹介ページ
- QUMAS DocCompliance™:コンプライアンス関連文書管理システム
- QUMAS ProcessCompliance™:是正予防措置(CAPA)、逸脱(Deviation)、監査管理(Audit)、変更管理(Change Control)、苦情管理(Complaints)、規格外(Out of Specification )などイベント管理システム
- QUMAS LMS:GxP業務対応教育訓練管理システム
- QUMAS ComplianceSP™:Microsoft SharePoint2010ベースのコンプライアンス・プラットフォーム
- QUMAS iX:GxPレギュレーションに対応した第三者企業・団体向け情報共有プラットフォーム
- QMSコンプライアンスソリューション:QMSにおける法規制・査察・監査に対応するGxPコンプライアンスシステム
- PharmaCUVICプレスリリース(2014年6月19日)
- PharmaCUVIC:ライフサイエンス業界向けクラウドサービスPharmaCUVIC
※記載されている商品名などの固有名詞は、各社の商標または登録商標です。
※掲載されている情報は、発表日現在の情報です。最新の情報と異なる場合がありますのでご了承ください。
以上
伊藤忠テクノソリューションズ株式会社
ライフサイエンス事業部
TEL:03-6403-2213/E-mail:
ls-marcom@ctc-g.co.jp