
-
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
イベント情報
-
ベンダー情報
-
ベンダー情報
-
イベント情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
イベントレポート
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
最新情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
イベント情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
イベント情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
ベンダー情報
-
最新情報
-
最新情報
-
ベンダー情報
-
最新情報
-
ベンダー情報
-
イベントレポート
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
イベントレポート
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
イベント情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
最新情報
-
ベンダー情報
-
イベント情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
ベンダー情報
-
関連トピックス
-
バイオ医薬品市場の規模拡大とバイオ医薬品製造(バイオプロセス)
バイオ医薬品とは、有効成分がタンパク質由来(成長ホル モン,インスリン,抗体など),生物由来の物質(細胞,ウイルス,バクテリアなど)により産生される医薬品を指します。(引用※1) 昨今、人体に近い成分であることから、より高い安全性や有効性が見込まれているため、創薬の主流が低分子医薬品からバイオ医薬品へとシフトしつつあります。世界と日本国内ともに、バイオ医薬品の売上高は年々増加しており、最近数年間においても高い成長率で市場規模が拡大しています。
バイオ医薬品の特徴は、低分子医薬品に比べて分子量が大きく、また抗体を中心に、核酸、ペプチド、遺伝子、細胞医薬など物質が多岐にわたります。そのためバイオ医薬品の製造工程(以下、バイオプロセス)は、低分子医薬品の製造工程と全く異なり、細胞や遺伝子など変化の影響を受けやすい生物資源が用いられるため、製造工程はより厳正な工程管理と品質管理が求められています。
第一世代のバイオ医薬品は、生体内に微量に存在するホルモンやサイトカインを微生物や細胞培養により大量生産されていましたが、その後抗体医薬品の出現により、第二世代のバイオ医薬品として実用化されるようになりました。バイオテクノロジーの技術革新と相まって、バイオ医薬品の生産供給体制が確立されてきており、大量生産するためのGMP製造施設を持つ製薬企業や、またバイオプロセスに対応可能な受託製造機関(CMO)も増加してきております。
引用)
※1 バイオ医薬品 医療の新しい時代を切り開く
※2 バイオ医薬品産業の現状と課題
※3 バイオ医薬産業の課題と更なる発展に向けた提言
バイオプロセスの一般的なワークフロー

一般的なバイオプロセスのワークフローと含まれる各工程を下図に示しました。
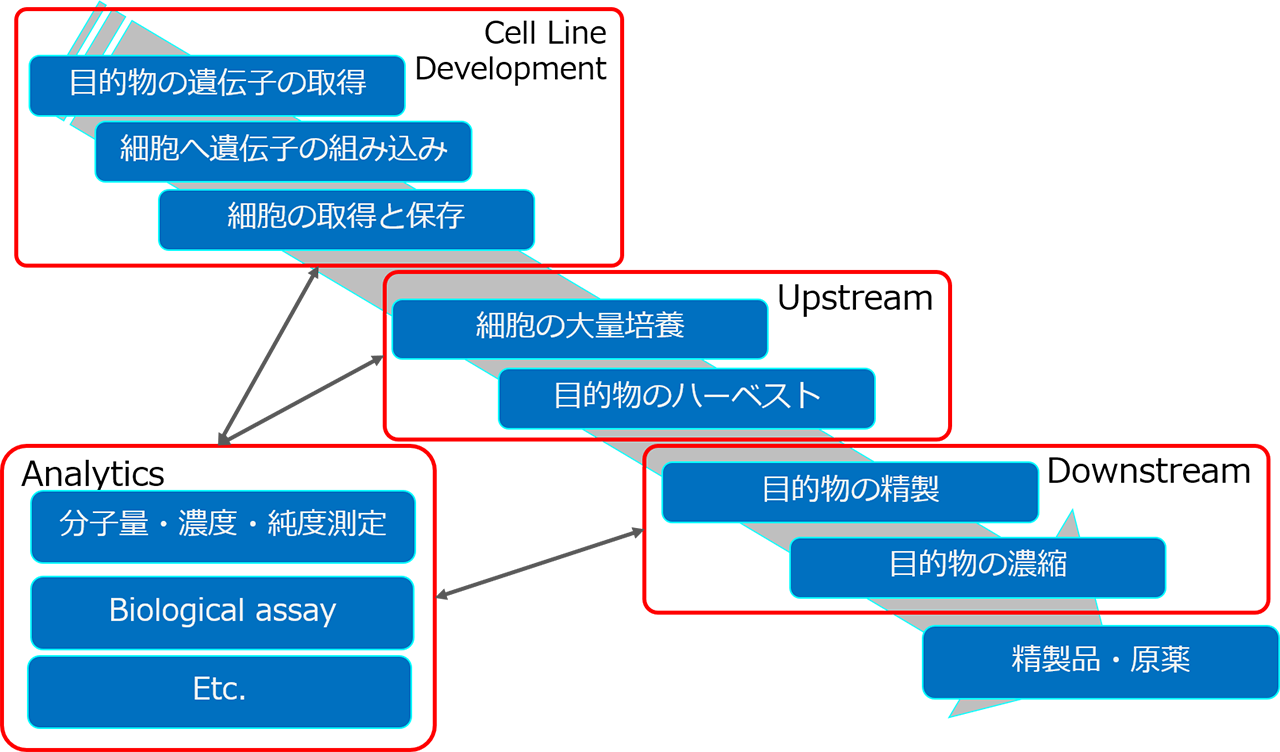
Cell Line Development(細胞株構築):
動物細胞宿主を用いたバイオ医薬品産生株の樹立を育種するプロセス。初期開発のこの段階では、培地や栄養成分の利用可能性、成長条件など、細胞の外部要因の影響を試行錯誤で検討します。バイオ医薬品市場が成長を続ける中、製薬企業では、競争優位性を高めるため、この開発フェーズのタイムラインを短縮する革新的な手法を模索しています。
市場の急成長の裏に潜む課題
Global Market Insightsによると、Cell Line Developmentは2023年までに75億ドルの市場になる可能性があり、現在のCAGR(年平均成長率)は毎年13%以上となっています。治療要件の変化やがんの種類、自己免疫疾患の多様化、コンパニオン診断法の進歩などの要因により、細胞株構築市場は健全な成長が見込まれています。とはいえ、バイオ治療用の細胞株は、特許の寿命と知的財産(IP)を最大化するために、できるだけ早く開発する必要があります。
成長を達成し、維持するための鍵となるのは、優れた品質の細胞株を迅速に開発することですが、それなりの課題があります。それは、これらの細胞を培養するための培地や栄養成分の種類や濃度、pH、温度など多数の条件を最適化し、細胞の挙動や活性のモニタリング、クローン選択のワークフローの定義などです。生産物がこれら生育条件の影響を受けやすいのが特徴ですが、複数の条件から因果関係を特定し、最適化を図ることは容易ではありません。
Upstream(アップストリーム):
Upstreamは、細胞株を使用して、商業的に許容される濃度と品質のバイオ医薬品を生産する工程です。
この工程の規模を拡大させるには、バイオ医薬品の力価と収率を最大化する最適な条件が必要です。バイオリアクター内の細胞株の生産能力は、Cell Line Developmentプロセスの初期段階で評価された後、異なるプロセスパラメータや培地/フィード条件の効果の分析により、プロセスがスケールアップされていきます。効果的なUpstreamの開発には、細胞バンク、クローンの安定性評価、シードの拡大培養、生産細胞培養などあらゆる段階において精度が求められます。
バイオ医薬品開発のUpstreamにおける課題
クローン病やアルツハイマー病、がん、炎症をはじめとする治療分野の研究が、バイオ医薬品の需要を後押ししています。このような市場の拡大に対応するために、製薬企業は、創薬・開発から規制当局の承認を経て、患者さんにできるだけ早く医薬品を届けるため、効率的なバイオ医薬品を開発する革新的な手法を求めています。
しかし、望ましい属性と要件に適合した品質を備えた、高濃度で安定した医薬品の生産を最大化するのは容易ではありません。多くの企業が ambr バイオリアクターシステムのような技術に投資して、予測スケールダウンモデルを開発し、統計的手法を使用しながら重要なプロセスパラメーター(CPP)の最適化を図っています。ラマン分光法などの分析技術の進歩もまた、パラメーターのリアルタイムモニタリングとプロセス制御を改善する可能性を秘めています。
Downstream(ダウンストリーム):
Downstreamは、バイオ医薬品の回収と精製のための様々なユニット操作開発が含まれます。Upstreamとは異なり、Downstreamは、必要な純度の製品を得るため、反復的にクロマトグラフィーやろ過が行われます。
Upstreamの最終段階には、細胞や細胞片などの大きな破片が含まれているため、品質を上げていく工程は、Downstreamから始まります。この段階では、DNAや宿主細胞のタンパク質を含むすべての残渣を除去しなければなりません。
Downstreamにおける具体的な課題
高品質の製品を生産するために、これらの作業をスケールアップして信頼性と再現性のある結果を適切な臨床使用のために提供することは、革新的な手順や技術を要します。バイオ医薬品への注目度の高まりを受けて、増大した需要に対応する必要に迫られています。
そのため製薬企業は、市場投入までの時間短縮とコスト削減することを常に模索しています。
多くの製薬企業がハイスループット技術に投資して、予測スケールダウンモデルを開発し、統計的手法を使用して、重要なプロセスパラメータ(CPP)の最適な動作範囲を可能な限り迅速に決定しています。特にウイルスベクターのような生産の難易度が高い製品の効率と収率を向上させるために、連続的な処理方法も開発されています。しかし、サンプルと分析結果のトレーサビリティーが課題となっています。
Analytics(分析):
バイオ医薬品は、薬物治療において急成長している分野であり、規制当局が医薬品を承認するためには、科学者はバッチ間の一貫性を実証し、精密な分析試験と特性評価により、プロセスステップの有効性を証明しなければなりません。
プロセス開発のライフサイクルを通して、生物サンプルは様々な機器分析が行われています。モノクローナル抗体のプラットフォーム分析法は十分に文書化されており、検証の手順が確立されています。しかし分析法開発チームでは、代替の生物学的実体の試験方法を検証することがあります。またライフサイクル全般の分析評価を支援しています。タンパク質発現を測定する力価アッセイでは、上流のサンプルからプロダクトの電荷とグリコシル化の評価により細胞株開発チームをサポートし、下流のプロセスでは宿主細胞タンパク質などの製品とプロセスに関連する不純物評価まで、分析科学者は医薬品の品質を評価し、主要な属性を測定、プロセスを改善または強化するためにフィードバックするという重要な役割を担っています。
バイオプロセスにおけるデータ取り扱いの課題
前項で、医薬品業界では、低分子医薬品では治療が困難であった疾患領域にも、有効で安全な治療法として、バイオ医薬品のニーズが高まっています。そしてそれに応えるため、製薬企業では、より迅速にバイオ医薬品を開発する技術を模索していると述べました。この開発スピードを向上させるために、適切なデータの取り扱いにも着目すべきでしょう。
バイオプロセスでは、各工程同士の情報連携が、後続のステップにおける成果を最大化するためにも重要となります。例えばCell Line Developmentの工程における培養の試行錯誤の過程や、最適と判断された条件を適切に引き継ぐことが、Upstreamにおけるスケールアップでは必須となります。仮に、望ましくない事象が見られた際にも、試行錯誤の過程で類似した事象がないか、トレースすることで有意な知見が得られる可能性があります。また使用するサンプルの品質による影響を受けやすいため、品質担保のためにも、用いた生物資材の情報を実験情報と関連付けて、記録管理することが求められます。用いた生物資材が期限切れやデータが不完全であった場合などは再試験する可能性もあります。これは、時間とコストを浪費するだけでなく、プロジェクトに遅延をもたらし、研究全体の生産性を低下させてしまいます。
このように実験結果だけでなく、バイオプロセス業務では、培養の条件から用いたサンプルまで、確実にデータを記録することが、試行錯誤する上での考察やコンプライアンス対応に欠かせません。しかし、現状はほとんどが紙や多数のExcelファイルを使用して、データの記録・共有が行われています。そのため、細かい条件まで含めた記録自体が困難であるのと、仮に記録されていても散逸した場所に記録されているので、試験を横断した考察をするには非常に難しいデータ管理がなされているのが現状です。その結果、問題の特定が遅れてしまうことがあります。新しい治療法の開発には多くの分析試験が必要であることを考えると、このような遅延は研究室の敏捷性と能力を著しく低下させる可能性があります。
このように、バイオプロセス業務では膨大な量のデータが生成されるにも関わらず、トレーサビリティや正確性を有したデータ管理において、多くの課題が見受けられます。
課題その1:このタンパク質調製の実験記録や分析記録を確認したいのに、どこにあるか、わからない、すぐに探せない…
課題その2:実験記録にはたどり着いたけれど、書き方や記載レベルが人によってばらばらで、統一されていないので、知りたい情報が見いだせない…
その結果、例えば、
- ✓どのような培養条件にすれば良好な結果が得られたか?など実験条件に対する分析がしづらい
- ✓Cell Line Developmentや培養など各過程で得られた結果と、調整したバイオ資材を紐づけて管理されていない
課題その3:調製したタンパク質が、どのCell line から、どういう実験操作(=精製中間体)を経て、得られたものなのか、関連する実験記録をひととおり調べてみないと分からない…
その結果、例えば、
- ✓コンタミしていることが判明した細胞やバイオ資材から、どのサンプルまで影響が懸念されるか、調査に膨大なリソースが必要

IDBS Bioprocess Solutionがこれらの課題を解決します!
- ワンプラットフォームに情報を集約
- Workflow Templateの使用により、管理されるデータを標準化
- 実験資材を一元管理することで厳正な品質管理
IDBS Bioprocess Solution の紹介
IDBS Bioprocess Solutionは、電子実験ノートシステムE-WorkBookを基盤とし、E-WorkBook AdvanceのSpreadsheet機能により、バイオプロセスの各業務に即して構築したTemplate、また在庫管理システムE-WorkBook Inventoryを連携させた、バイオプロセス業務の一連のワークフローを支援する統合ソリューションです。
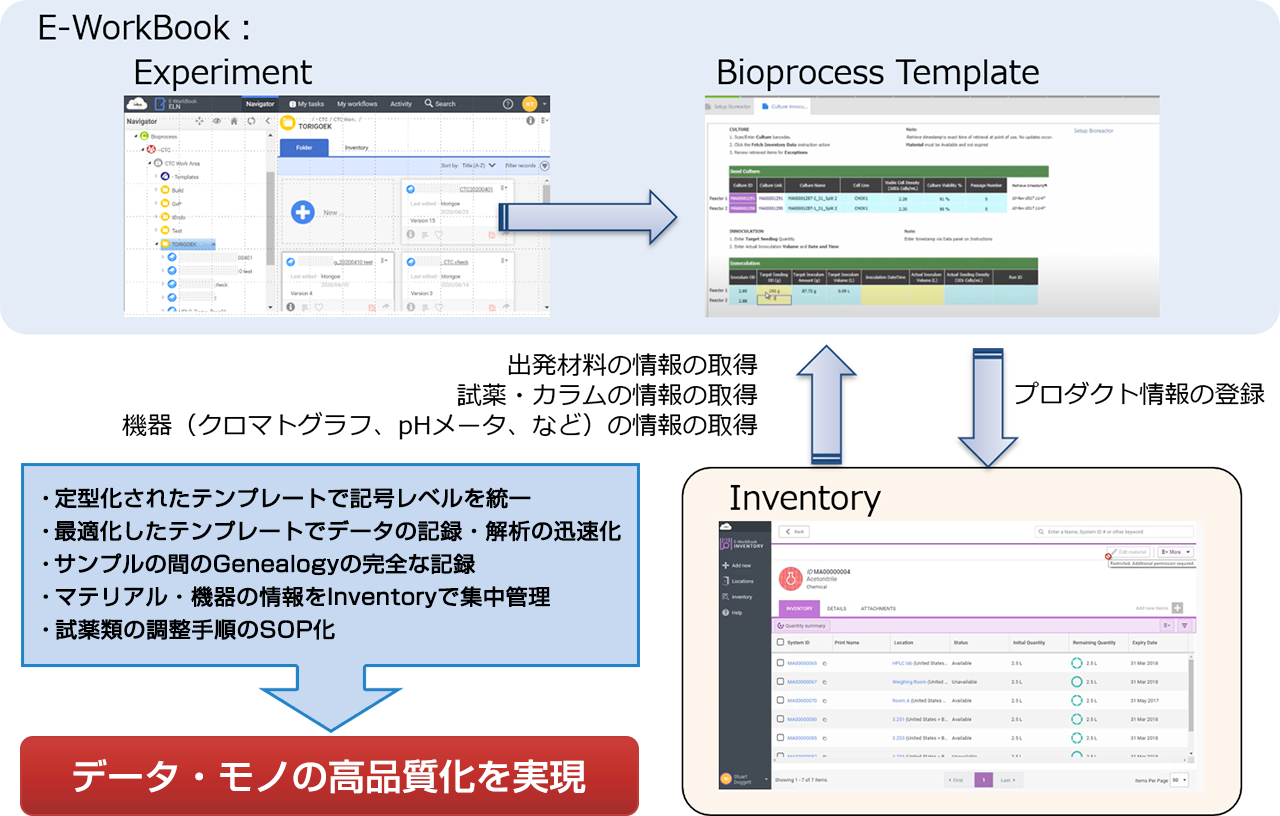
統合された電子システムは、バイオプロセス業務におけるデータ管理の課題解決に役立つだけでなく、ビジネスルールやSOP(標準作業手順書)からの逸脱のチェックも支援します。 Downstreamのプロセスへと進める前に、Upstreamのプロセス内で、問題や逸脱を実行時点でフラグを立てることで、再実験などを回避できるため、組織の時間とコストの節減に貢献します。
また多次元Spreadsheetで構築されたTemplateを使用することで、実験後のデータチェック(QCチェック)の負荷を低減できます。
またバイオプロセス業務全般を横断したデータが取得可能となるため、部門を跨いでリアルタイムな分析結果の共有や、多数のパラメーターから最適な培養条件の考察を支援します。
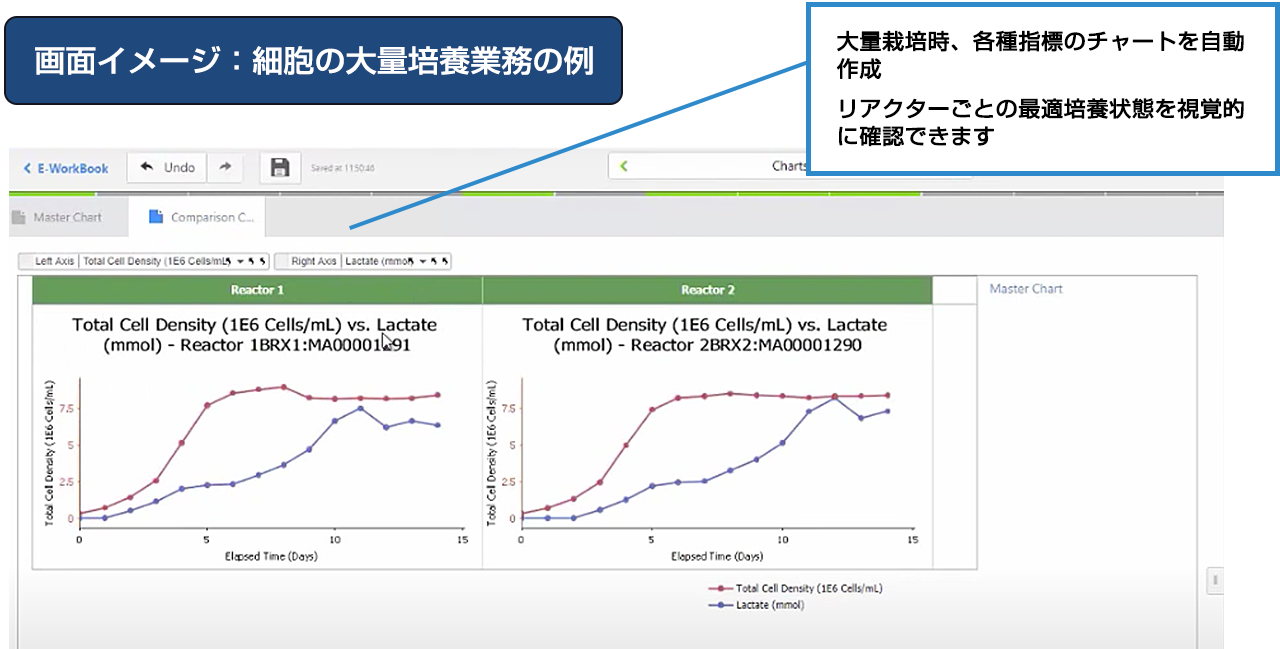
利用シーン:Upstream
Upstream向けIDBSバイオプロセスソリューション
https://www.youtube.com/watch?v=c-2nFY3IoPk
IDBS Biopharamceutical lifecycle management platformは、Upstreamの統合されたプラットフォームを提供します。開発ライフサイクル全体を通して、科学者、実験装置、データソースを横断したワークフローをシームレスに実行することで、効率性を高め、より良い洞察力とプロセス理解を可能にします。

利用シーン:QAチェック
QAの負荷削減
https://www.youtube.com/watch?v=wr17GRvFKjg
IDBSバイオプロセスソリューションがどのようにしてQAオーバーヘッドの削減を実現するのかについてご紹介しています。シンプルなステップにより、品質保証(QA)のオーバーヘッドを70%も削減することができます。
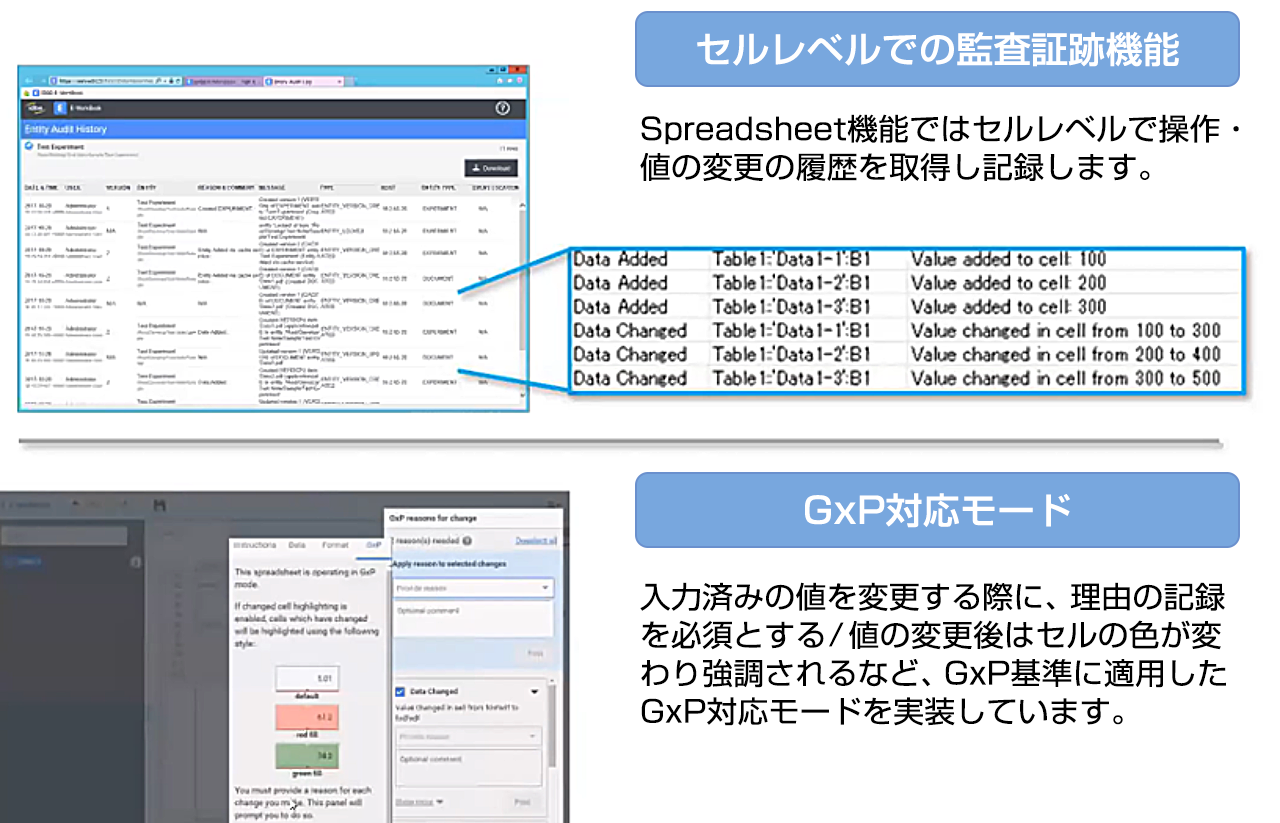
監査証跡機能(オーディットトレイル)
標準装備の監査証跡機能より、Spreadsheetへの変更(入力・修正・削除)は、全てログとして記録されます。いつ、だれが、どのように変更したか追跡できるため、GMP試験の記録管理にも使用できます。
導入実績
Lonza(Switzerland)
バイオ医薬品受託製造期間であるLonza社では、バイオ医薬品のプロセス開発、製造で発生するデータ管理・業務支援システムとしてIDBS社Bioprocess Execution Systemを導入。当システムを導入することで、単に実験データの電子化と一元管理だけでなく、業務ワークフローの最適化へと繋がった。
事例資料のダウンロードはこちらから
「ホワイトペーパー:高品質でより迅速な結果の提供を製薬プラットフォームで実現する」(PDFファイル・日本語)
〜 分析開発と品質管理(QC)の両方のニーズを満たす方法とは 〜

- 開発組織全体での共通データ管理による、堅牢なプロセス開発やデータ転送の高速化、コスト削減、品質向上、企業イメージ向上を可能にする方法について説明しています。このホワイトペーパーでは、分析開発とQCのチームが「プラットフォームアプローチ」を採用することで得られるメリットに加えて、統合型開発プラットフォーム(Integrated Development Platform)が分析開発とQCの両方のニーズを満たす点についても説明しています。
資料請求はコチラ






