-
製品トピックス
CTCLS、安全性評価研究会のセミナーにて、FDAが将来求める非臨床試験データ標準(CDISC SENDデータ)について講演
製薬・医療機器を始めライフサイエンス業界にソリューションを提供しているCTCライフサイエンス株式会社(以下、CTCLS)は、2014年12月6日(土)、東京都品川区の住友ベークライト株式会社で開催された「安全性評価研究会2014年冬のセミナー」(主催:同会事務局)のランチョンセミナーにおいて、米国食品医薬品局(以下、FDA)が今後製造販売申請時に要求する非臨床試験データ標準フォーマット(以下、SEND)について講演を行いました。また、英国Instem plc.(以下、Instem社)のSEND対応ソリューションも紹介しました。


ランチョンセミナー
以下が、本講演の概要です。
演題:非臨床試験の電子データ提出-FDAが求めるSEND標準について-
演者:CTCLS技術第1部 イアン・キャメロン

SENDの基礎
米国が発令した「処方せん薬ユーザーフィー法」(Prescription Drug User Fee Actの略、以下PDUFA)は、新薬承認の高速化を目的としています。しかし、FDAは毎年製薬企業から膨大な申請データを受け取っており、承認審査に掛かる労力と時間の軽減が課題となっていました。そこでFDAは、効率化を図るため、2012年に制定されたPDUFA Vにて、申請元である製薬企業に対して臨床試験や非臨床試験の申請用データの電子化の必要性を提唱しました。
以後FDAは、提出用試験データ電子化の標準的なフォーマットの準備に取り組み、非臨床試験データの標準フォーマットにSENDを採用しました。SENDは、米国に本拠地を置くCDISCが主管して、臨床データ用SDTMフォーマットに基づき非臨床データ専用に開発されました。そして2014年12月17日に発表されたファイナルガイダンスにより、2016年12月18日以降に開始する試験からSENDデータ提出の義務化が正式に策定されました。
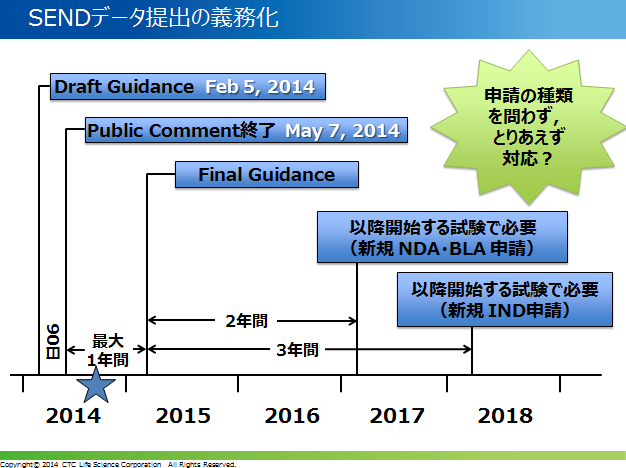
現在FDAにて本番運用しているのが、SENDインプリメンテーションガイド(Standard for Exchange of Nonclinical Data Implementation Guide、以下SEND IG)バージョン3.0で定義されているSEND 3.0です。単回投与毒性試験、反復投与毒性試験、がん原性試験のデータに対応しています。
次期バージョンの3.1は、FDAの受信テスト完了を受けて2014年11月にドラフト版がリリースされ、v3.0の改正に加え、呼吸器、循環機能検査など安全性薬理試験用のドメインが追加されました。また,胎児毒性試験はじめ生殖発生毒性試験においては、新たに別のガイドが開発されており、現在受信テストに向けて準備を進めています。
申請に必要な提出用データは、一試験ごとに複数の「データセットファイル(XPT形式)」、「Data Definition File(以下、Define.xml)」、「Nonclinical Data Reviewer's Guide(以下、Reviewer's Guide)」の3種類あります。
データセットファイルは、試験デザイン、動物情報、投与、検査結果など試験データを格納するテーブルです。このデータセットで利用する用語には2種類あり、米NCIが管理する辞書をベースに開発した「CDISC Controlled Terminology(以下、統制用語集)」と、統制用語集では網羅できていない一般状態や剖検所見については自社独自に定義した用語集を補完的に利用します。統制用語集は定期的に更新されており、研究者からの依頼による用語登録にも対応します。
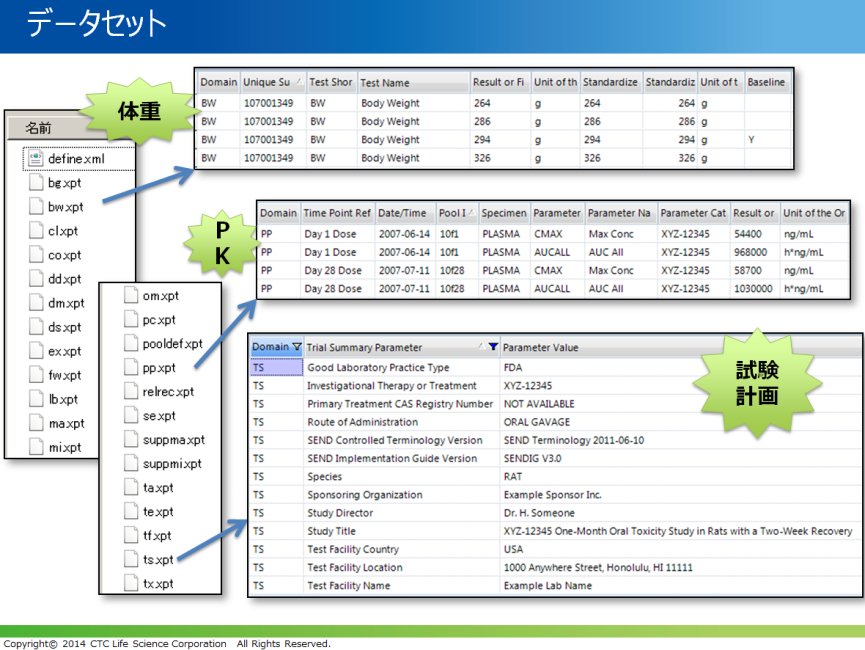
Define.xml は、データセットファイルのドメイン構成や用語に関するメタデータを格納します。
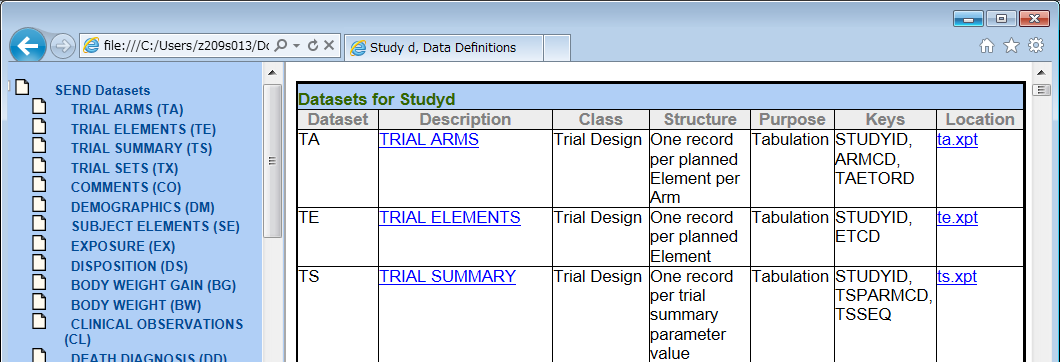
Reviewer's Guideは、データセットファイルとDefine.xmlが記述しきれない、データセットファイルのチェック実施有無や、データ作成時に起こった問題、プロトコルの特徴などの情報を説明する文書です。
SEND対応に向けて
製薬企業がSEND対応に向けて、先ず必要となるのが情報収集です。現状の運用を分析し、課題や対応策を明確にしてから、人員体制構築など準備を進めます。次にSENDデータの出力や受領の開始時期、導入するシステムを自社開発またはパッケージ製品にするかを選択します。いずれの場合も、自社環境へのシステム導入後は、コンピュータ化システムバリデーション(CSV)作業が必要になります。またシステム導入に伴い変更される業務に関するSOP作成やエンドユーザへの教育には、ベンダーだけでなく研究者の積極的な参加も重要となります。
医薬品開発受託機関(以下、CRO)を利用する場合は、運用開始にむけたスケジュールや、SENDや統制用語集のバージョンなど納品データの形式について、CROと予め合意しておくことが必要です。また、一試験について複数の試験機関が関わる場合もあるため、生成した複数のデータセットを統合させる運用の検討も視野に入れる必要があります
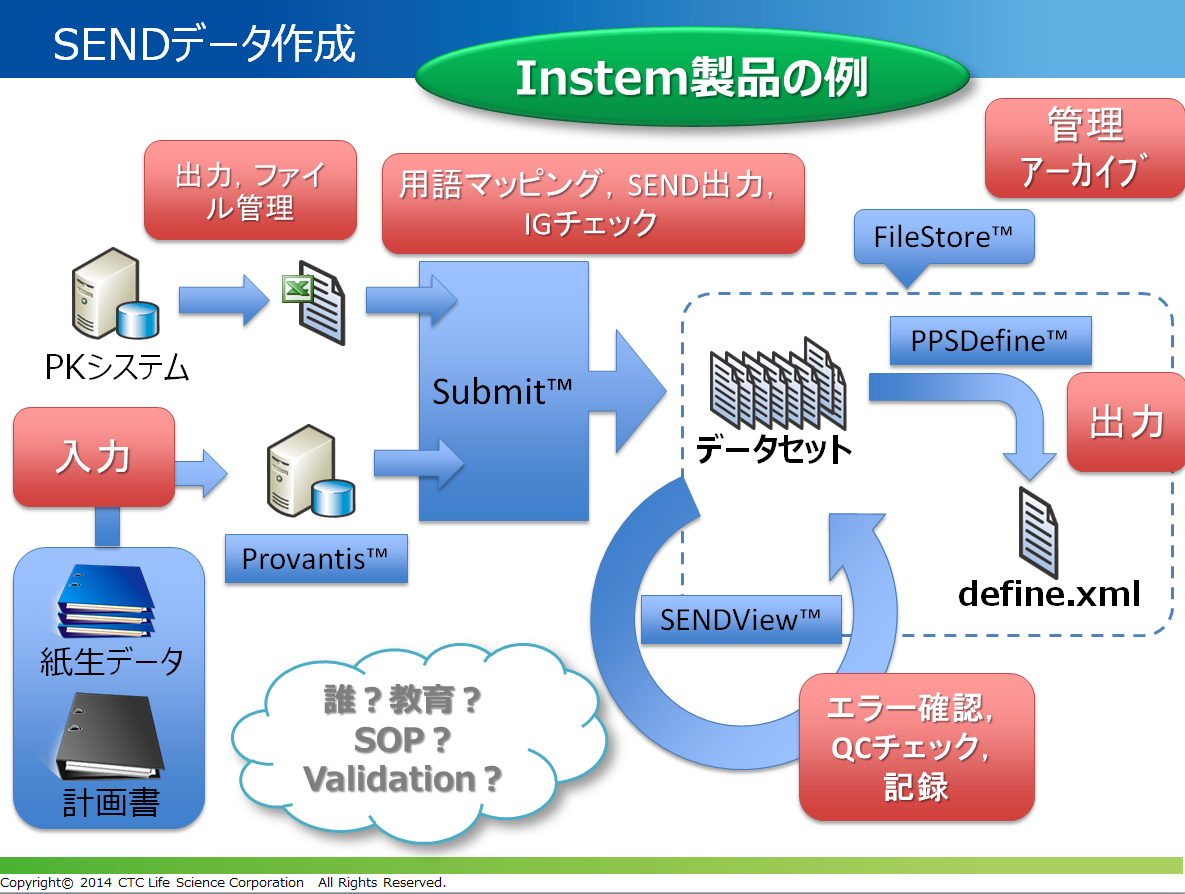
以下の図は、Instem社製品を用いた場合のSEND作成のフローを示しています。Provantis以外のシステムで安全性試験情報を管理している場合も、SENDデータの作成や管理が実現可能です。
今後もCTCLSは、規制要件の最新動向をいち早く把握し、セミナーでの発表またはホームページなどを通じて情報発信を行います。
CTCライフサイエンス株式会社について
CTCLSは1989年の創業以来、製薬企業を中心としたライフサイエンス業界のお客様を対象にICTソリューションの提供を通して、その課題解決に貢献してきました。CTCLSの強みは、伊藤忠テクノソリューションズ(CTC)グループの最先端かつ広範なICT技術力、先進のサイエンスを取り入れた製品を有するベンダーとの強固なパートナーシップ、そして薬学や生命科学に関する深い理解と豊富な業務知識に基づくコンサルティング力です。これらを活かして、ICTとライフサイエンスの両方の視点から、海外の最先端のサイエンス製品とICT製品・サービスを融合し、単なるシステム構築にとどまることなく、お客様ごとの業務や課題を踏まえた最適なソリューションを提供します。
CTCLSの詳細については http://ls.ctc-g.co.jp/index.html をご覧ください。
製品紹介ページ
※記載されている商品名などの固有名詞は、各社の商標または登録商標です。
※掲載されている情報は、発表日現在の情報です。最新の情報と異なる場合がありますのでご了承ください。
以上
伊藤忠テクノソリューションズ株式会社
ライフサイエンス事業部
TEL:03-6403-2213/E-mail:
ls-marcom@ctc-g.co.jp

